Resolução das Questões do Enem - lista7/10
Eletroquímica
1. (Enem 2009) Para que apresente condutividade elétrica adequada a muitas aplicações, o cobre bruto obtido por métodos térmicos é purificado eletroliticamente. Nesse processo, o bruto impuro constitui o ânodo da célula, que está imerso em uma solução de CuSO4. À medida que o cobre impuro é oxidado no ânodo, íons Cu2+ da solução são depositados na forma pura no cátodo. Quanto às impurezas metálicas, algumas são oxidadas, passando à solução, enquanto outras simplesmente se desprendem do ânodo e se sedimentam abaixo dele. As impurezas sedimentadas são posteriormente processadas, e sua comercialização gera receita que ajuda a cobrir os custos do processo. A série eletroquímica a seguir lista o cobre e alguns metais presentes como impurezas no cobre bruto de acordo com suas forças redutoras relativas.
Entre as impurezas metálicas que constam na série apresentada, as que se sedimentam abaixo do ânodo de cobre são
a) Au, Pt, Ag, Zn, Ni e Pb.
b)Au, Pt e Ag.
c) Zn, Ni e Pb.
d) Au e Zn.
e) Ag e Pb.
Resolução:
Todos os elementos com maior potencial de oxidação que o cobre vão se oxidar, pois se o potencial é suficiente para oxidar o cobre, todos com maior potencial se oxidam também. Todos que têm menor potencial de oxidação, não vão se oxidar e continuam sólidos e se sedimentam no fundo da solução.
Quanto maior a força redutora, maior a capacidade desse elemento reduzir um outro elemento e maior sua capacidade de oxidação. Sendo assim, os que reduzem com maior facilidade são os metais nobres, os mais acima da tabela.
Opção B
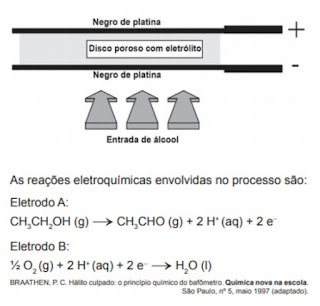
2. (Enem 2011) Iniciativas do poder público para prevenir o uso de bebidas alcoólicas por motoristas, causa de muitos acidentes nas estradas do país, trouxeram à ordem do dia, não sem suscitar polêmica, o instrumento popularmente conhecido como bafômetro. Do ponto de vista de detecção e medição, os instrumentos normalmente usados pelas polícias rodoviárias do Brasil e de outros países utilizam o ar que os “suspeitos” sopram para dentro do aparelho, através de um tubo descartável, para promover a oxidação do etanol a etanal. O método baseia-se no princípio da pilha de combustível: o etanol é oxidado em meio ácido sobre um disco plástico poroso coberto
com pó de platina (catalisador) e umedecido com ácido sulfúrico, sendo um eletrodo conectado a cada lado desse disco poroso. A corrente elétrica produzida, proporcional à concentração de álcool no ar expirado dos pulmões da pessoa testada, é lida numa escala que é proporcional ao teor de álcool no sangue. O esquema de funcionamento desse detector de etanol pode ser visto na figura.
No estudo das pilhas, empregam-se códigos e nomenclaturas próprias da Química, visando caracterizar os materiais, as reações e os processos envolvidos. Nesse contexto, a pilha que compõe o bafômetro apresenta o
a) eletrodo A como cátodo.
b) etanol como agente oxidante.
C) eletrodo B como polo positivo.
d) gás oxigênio como agente redutor.
e) fluxo de elétrons do eletrodo B para o eletrodo A
Resolução:
O polo positivo é onde ocorre a reação que produz água. Desta forma, no eletrodo B ocorre redução e é o cátodo, ocorrendo o fluxo de elétrons do eletrodo A para o B, pois o fluxo segue de quem oxida para quem reduz.
Opção C
3. (Enem 2004) Ferramentas de aço podem sofrer corrosão e enferrujar. As etapas químicas que correspondem a esses processos podem ser representadas pelas equações:

Uma forma de tornar mais lento esse processo de corrosão e formação de ferrugem é engraxar as ferramentas. Isso se justifica porque a graxa proporciona
a) lubrificação, evitando o contato entre as ferramentas.
b) impermeabilização, diminuindo seu contato com o ar úmido.
c) isolamento térmico, protegendo-as do calor ambiente.
d) galvanização, criando superfícies metálicas imunes.
e) polimento, evitando ranhuras nas superfícies.
Resolução:
A impermeabilização impede o contato do metal com ar úmido porque forma uma camada de proteção que dificulta a formação de ferrugem.
Opção B
4. (Enem 2013) Eu também podia decompor a água, se fosse salgada ou acidulada, usando a pilha de Daniell como fonte de força. Lembro o prazer extraordinário que sentia ao decompor um pouco de água em uma taça para ovos quentes, vendo-a separar-se em seus elementos, o oxigênio em um eletrodo, o hidrogênio no outro. A eletricidade de uma pilha de 1 volt parecia tão fraca, e no entanto podia ser suficiente para desfazer um composto químico, a água…
SACKS, O. Tio Tungstênio: memórias de uma infância química. São Paulo: Cia. das Letras, 2002
O fragmento do romance de Oliver Sacks relata a separação dos elementos que compõem a água. O princípio do método apresentado é utilizado industrialmente na
a) obtenção de ouro a partir de pepitas.
b) obtenção de calcário a partir de rochas.
c) obtenção de alumínio a partir da bauxita.
d) obtenção de ferro a partir de seus óxidos.
e)obtenção de amônia a partir de hidrogênio e nitrogênio.
Resolução:
A obtenção do alumínio a partir da bauxita ocorre pela eletrólise assim como ocorreu a obtenção do hidrogênio e do oxigênio a partir da água.
Opção C
5. (Enem 2012) O boato de que os lacres das latas de alumínio teriam um alto valor comercial levou muitas pessoas a juntarem esse material na expectativa de ganhar dinheiro com sua venda. As empresas fabricantes de alumínio esclarecem que isso não passa de uma “lenda urbana”, pois ao retirar o anel da lata, dificulta-se a reciclagem do alumínio. Como a liga do qual é feito o anel contém alto teor de magnésio, se ele não estiver junto com a lata, fica mais fácil ocorrer a oxidação do alumínio no forno. A tabela apresenta as semirreações e os valores de potencial padrão de redução de alguns metais:
Com base no texto e na tabela, que metais poderiam entrar na composição do anel das latas com a mesma função do magnésio, ou seja, proteger o alumínio da oxidação nos fornos e não deixar diminuir o rendimento da sua reciclagem?
a) Somente o lítio, pois ele possui o menor potencial de redução.
b) Somente o cobre, pois ele possui o maior potencial de redução.
c) Somente o potássio, pois ele possui potencial de redução mais próximo do magnésio.
d) Somente o cobre e o zinco, pois eles sofrem oxidação mais facilmente que o alumínio.
e) Somente o lítio e o potássio, pois seus potenciais de redução são menores do que o do alumínio.
Resolução:
É uma questão sobre corrosão em que é necessário proteger o alumínio da oxidação. Para tal, utilizamos o magnésio porque ele apresenta o potencial de redução menor, ou seja, o que vai oxidar no lugar no alumínio. Nessa questão, podemos escolher qualquer metal que tenha menor potencial de redução que o alumínio. De acordo com a tabela, além do magnésio, podemos verificar o lítio e o potássio.
Opção E
6. (Enem 2014) A revelação das chapas de raios X gera uma solução que contém íons prata na forma de Ag(S2O3)2-3 . Para evitar a descarga desse metal no ambiente, a recuperação de prata metálica pode ser feita tratando eletroquimicamente essa solução com uma espécie adequada. O quadro apresenta semirreações de redução de alguns íons metálicos
Das espécies apresentadas, a adequada para essa recuperação é
a) Cu (s).
b) Pt (s).
c) Al3+(aq).
d) Sn (s).
e) Zn2+(aq)
Resolução:
Para conseguir a recuperação da prata metálica, deve-se utilizar a espécie que tenha menor potencial para que a prata reduza. Pela tabela, poderiam ser utilizadas o alumínio, o estanho e o zinco. Porém, nas opções somente o estanho está na forma correta, ou seja, na forma metálica.
Opção D
7. (Enem 2014) Os bafômetros (etilômetros) indicam a quantidade de álcool, C2H6O (etanol), presente no organismo de uma pessoa através do ar expirado por ela. Esses dispositivos utilizam células a combustível que funcionam de acordo com as reações químicas representadas:
Na reação global de funcionamento do bafômetro, os reagentes e os produtos desse tipo de célula são
a) o álcool expirado como reagente; água, elétrons e H+ como produtos.
b) o oxigênio do ar e H+ como reagentes; água e elétrons como produtos.
c) apenas o oxigênio do ar como reagente; apenas os elétrons como produto.
d) apenas o álcool expirado como reagente; água, C2H4O e H+ como produtos.
e) o oxigênio do ar e o álcool expirado como reagentes; água e C2H4O como produtos.
Resolução:
Na equação global do álcool expirado e o oxigênio teremos como produtos C2H4O e água.
Opção E
8.(Enem 2015) O alumínio é um metal bastante versátil, pois, a partir dele, podem-se confeccionar materiais amplamente utilizados pela sociedade. A obtenção do alumínio ocorre a partir da bauxita, que é purificada e dissolvida em criolita fundida (Na3AlF6) e eletrolisada a cerca de 1000 °C. Há a liberação do gás dióxido de carbono (CO2), formado a partir da reação de um dos produtos da eletrólise com o material presente nos eletrodos. O ânodo é formado por barras de grafita submergidas na mistura fundida. O cátodo é uma caixa de ferro coberta de grafita. A reação global do processo é:

Na etapa de obtenção do alumínio líquido, as reações que ocorrem no cátodo e ânodo são
Resolução:
Pela equação de oxiredução, pode-se perceber que o alumínio sofre uma redução, e esse processo ocorre no cátodo. No ânodo, o oxigênio sofre oxidação e após isso, atua sobre o eletrodo de carbono, oxidando-o.
Opção A
9.(Enem 2015) A calda bordalesa é uma alternativa empregada no combate a doenças que afetam folhas de plantas. Sua produção consiste na mistura de uma solução aquosa de sulfato de cobre(II), CuSO4, com óxido de cálcio, CaO, e sua aplicação só deve ser realizada se estiver levemente básica. A avaliação rudimentar da basicidade dessa solução é realizada pela adição de três gotas sobre uma faca de ferro limpa. Após três minutos, caso surja uma mancha avermelhada no local da aplicação, afirma-se que a calda bordalesa ainda não está com a basicidade necessária. O quadro apresenta os valores de potenciais padrão de redução (Eo) para algumas semirreações de redução.
A equação química que representa a reação de formação da mancha avermelhada é:
a) Ca2+(aq) + 2Cu+(aq) --> Ca(s) + 2Cu2+(aq)).
b) Ca2+(aq) + 2Fe2+(aq) --> Ca(s) + 2Fe3+(aq).
c) Cu2+(aq) + 2 Fe2+(aq) --> Cu(s) + 2Fe3+(aq).
d) 3Ca2+(aq) + 2 Fe(s) --> 3 Ca(s) + 2Fe3+(aq).
e) 3 Cu2+(aq) + 2 Fe(s) --> 3 Cu(s) + 2 Fe3+(aq).
Resolução:
Como a reação ocorre em uma faca de ferro ( ferro metálico) com CuSO4 e CaO, ocorre a oxidação do ferro metálico e reduz o cobre II . Importante observar que o potencial de redução do cobre é maior que do ferro, por isso ele reduz e o ferro oxida.
Opção E
10.(Enem 2019) Para realizar o desentupimento de tubulações de esgotos residenciais, é utilizada uma mistura sólida comercial que contém hidróxido de sódio (NaOH) e outra espécie química pulverizada. Quando é adicionada água a essa mistura, ocorre uma reação que libera gás hidrogênio e energia na forma de calor, aumentando a eficiência do processo de desentupimento. Considere os potenciais padrão de redução (E0) da água e de outras espécies em meio básico, expresso no quadro.
Qual é a outra espécie que está presente na composição da mistura sólida comercial para aumentar sua eficiência?
a) Al
b) Co
c) Cu(OH)2
d) Fe(OH)2
e) Pb
Resolução;
De acordo com a tabela, os compostos com menor potencial de redução em comparação à água são o alumínio (- 2,33 V) e o ferro (- 0,88 V). Entre as opções, aquela que utiliza como reagente da oxidação é a letra A. A opção D que apresenta o Fe(OH)2 está errada pois o correto seria Fe.
Opção A
11.(Enem 2009) - Pilhas e baterias são dispositivos tão comuns em nossa sociedade que, sem percebermos, carregamos vários deles junto ao nosso corpo; elas estão presentes em aparelhos de MP3, relógios, rádios, celulares etc. As semirreações descritas a seguir ilustram o que ocorre em uma pilha de óxido de prata. Pode-se afirmar que esta pilha
a) é uma pilha ácida.
b) apresenta o óxido de prata como o ânodo.
c) apresenta o zinco como o agente oxidante.
d) tem como reação da célula a seguinte reação: Zn(s) + Ag2O(s) → ZnO(s) + 2Ag(s)
e) apresenta fluxo de elétrons na pilha do eletrodo de Ag2O para o Zn.
Resolução:
Trata-se de uma pilha alcalina por ter a presença de OH- na equação química.
O fluxo de elétrons numa pilha sempre vai no sentido do ânodo para o cátodo. Neste caso, do zinco para o Ag2O
Opção D