Resolução das Questões do Enem - lista 10/10
Reações Orgânicas
1.( Enem 2018) A hidroxilamina é extremamente reativa em reações de substituição nucleofílica, justificando sua utilização em diversos processos. A reação de substituição nucleofílica entre o anidrido acético e a hidroxilamina está representada.
O produto A é favorecido em relação ao B, por um fator de 105. Em um estudo de possível substituição do uso de hidroxilamina, foram testadas as moléculas numeradas de 1 a 5.
Dentre as moléculas testadas, qual delas apresentou menor reatividade?
a) 1
b) 2
c) 3
d) 4
e) 5
Resolução:
Entre as moléculas testadas, a 4 não possui átomos hidrogênios ionizáveis ligados diretamente ao nitrogênio e oxigênio dificultando a ocorrência da reação pelo impedimento espacial. Por isso a molécula 4 apresenta a menor reatividade.
Opção D
2. ( Enem 2017) A ozonólise, reação utilizada na indústria madeireira para a produção de papel, é também utilizada em escala de laboratório na síntese de aldeídos e cetonas. As duplas ligações dos alcenos são clivadas pela oxidação com o Ozônio (O), em presença de água e zinco metálico, e a reação produz aldeídos e/ou cetonas, dependendo do grau de substituição da ligação dupla. Ligações duplas dissubstituídas geram cetonas, enquanto as ligações duplas terminais ou monossubstituídas dão origem a aldeídos. Como mostra o esquema.
Considere a ozonólise do composto 1-fenil-2-metilprop-1-eno:
MARTINO, A, Química, a ciência global, Goiânia: Editora W, 2014 (adaptado),
Ouais são os produtos formados nessa reação?
a) Benzaldeido e propanona.
b) Propanal e benzaldeido.
c) 2-fenil-etanale metanal.
d) Benzeno e propanona.
e) Benzaldeído e etanal.
Resolução:
A ozonólise gera a quebra da ligação dupla ligação entre carbonos, transformando os carbonos que são ligados às carbonilas em benzaldeído e a propanona. Ozonólise de carbonos primários e secundários produz aldeído, e de carbonos terciários, cetonas.
Opção A
3. (Enem 2012) Em uma planície, ocorreu um acidente ambiental em decorrência do derramamento de grande quantidade de um hidrocarboneto que se apresenta na
forma pastosa à temperatura ambiente. Um químico ambiental utilizou uma quantidade apropriada de uma solução de para-dodecil-benzenossulfonato de
sódio, um agente tensoativo sintético, para diminuir os impactos desse acidente.
Essa intervenção produz resultados positivos para o ambiente porque
a) promove uma reação de substituição no hidrocarboneto, tornando-o menos letal ao ambiente.
b) a hidrólise do para-dodecil-benzenossulfonato de sódio produz energia térmica suficiente para vaporizar o hidrocarboneto.
c) a mistura desses reagentes provoca a combustão do hidrocarboneto, o que diminui a quantidade dessa substância na natureza.
d) a solução de para-dodecil-benzenossulfonato possibilita a solubilização do hidrocarboneto.
e) o reagente adicionado provoca uma solidificação do hidrocarboneto, o que facilita sua retirada do ambiente.
Resolução:
A solução para-dodecil-benzenossulfonato apresenta uma parte polar e outra apolar. Sabendo que o hidrocarboneto é apolar e que apolar dissolve apolar, a parte apolar do composto para-dodecil-benzenossulfonato solubilizará o hidrocarboneto, facilitando a remoção.
Opção D
4.(Enem 2017) O trinitrotolueno (TNT) é um poderoso explosivo obtido a partir da reação de nitração do tolueno, como esquematizado. A síntese do TNT é um exemplo de reação de:O trinitrotolueno (TNT) é um poderoso explosivo obtido a partir da reação de nitração do tolueno, como esquematizado.
A síntese do TNT é um exemplo de reação de:
a) Neutralização.
b) Desidratação.
c) Substituição.
d) Eliminação.
e) Oxidação.
Resolução:
No caso do tolueno é possível no máximo três substituições no núcleo do anel benzênico: duas em orto e uma em para.
Opção C
5. (Enem 2012) A própolis é um produto natural conhecido por suas propriedades anti-inflamatórias e cicatrizantes. Esse material contém mais de 200 compostos identificados até o momento. Dentre eles, alguns são de estrutura simples,
como é o caso do C6H5CO2CH2CH3, cuja estrutura está mostrada a seguir.
O ácido carboxílico e o álcool capazes de produzir o éster em apreço por meio da reação de esterificação são,respectivamente,
a) ácido benzoico e etanol.
b) ácido propanoico e hexanol.
c) ácido fenilacético e metanol.
d) ácido propiônico e cicloexanol.
e) ácido acético e álcool benzílico.
Resolução:
O ácido carboxílico é o ácido benzóico e o álcool é o etanol. A esterificação é uma reação química entre um ácido carboxílico e um álcool, produzindo éster e água.
Opção A
6. (Enem 2015) O permanganato de potássio (KMnO4) é um agente oxidante forte muito empregado tanto em nível laboratorial quanto industrial. Na oxidação de alcenos de cadeia normal, como o 1-fenil-propeno, ilustrado na figura, o KMnO4 é utilizado para a produção de ácidos carboxílicos.
Os produtos obtidos na oxidação do alceno representado, em solução aquosa de KMnO4, são:
a) Ácido benzoico e ácido etanoico
b) Ácido benzoico e ácido propanoico.
c) Ácido etanoico e ácido 2-feniletanoico.
d) Ácido 2-feniletanoico e ácido metanoico.
e) Ácido 2-feniletanoico e ácido propanoico.
Resolução:
Os produtos obtidos na oxidação do alceno são ácido benzoico e ácido etanoico. A oxidação vai ocorrer no carbono mais próximo ao anel e quebra a ligação dupla do propeno formando dois ácidos carboxílicos.
Opção A
7. ( Enem 2011) A bile é produzida pelo fígado, armazenada na vesícula biliar e tem papel fundamental na digestão de lipídeos. Os sais biliares são esteroides sintetizados no fígado a partir do colesterol, e sua rota de síntese envolve várias etapas. Partindo do ácido cólico representado na figura, ocorre a formação dos ácidos glicocólico e taurocólico; o prefixo glico- significa a presença de um resíduo do aminoácido glicina e o prefixo tauro-, do aminoácido taurina.
A combinação entre o ácido cólico e a glicina ou taurina origina a função amida, formada pela reação entre o grupo amina desses aminoácidos e o grupo
a) carboxila do ácido cólico.
b) aldeído do ácido cólico.
c) hidroxila do ácido cólico.
d) cetona do ácido cólico.
e) éster do ácido cólico.
Resolução:
A combinação entre o ácido cólico e a glicina ou taurina origina a função amida, formada pela reação entre o grupo amina desses aminoácidos e o grupo carboxila do ácido cólico. A formação da amida ocorre pela reação da amina com ácido carboxílico pelo fato da carbonila estar presente.
Opção A
8. (Enem 2014) Grande quantidade dos maus odores do nosso dia a dia está relacionada a compostos alcalinos. Assim, em vários desses casos, pode-se utilizar o vinagre, que contém entre 3,5% e 5% de ácido acético, para diminuir ou eliminar o mau cheiro. Por exemplo, lavar as mãos com vinagre e depois enxaguá-las com água elimina o odor de peixe, já que a molécula de piridina (C5H5N) é uma das substâncias responsáveis pelo odor característico de peixe podre.
SILVA, V. A.; BENITE, A. M. C.; SOARES, M. H. F. B. Algo aqui não cheira bem… A química do mau cheiro. Química Nova na Escola, v. 33, n. 1, fev. 2011 (adaptado).
A eficiência do uso do vinagre nesse caso se explica pela
a) sobreposição de odor, propiciada pelo cheiro característico do vinagre.
b) solubilidade da piridina, de caráter ácido, na solução ácida empregada.
c) inibição da proliferação das bactérias presentes, devido à ação do ácido acético.
d) degradação enzimática da molécula de piridina, acelerada pela presença de ácido acético.
e) reação de neutralização entre o ácido acético e a piridina, que resulta em compostos sem mau odor.
Resolução:
Como a piridina tem caráter básico e entra em contato com um ácido, teremos uma reação de neutralização, resultando em compostos sem mau odor. Reação de neutralização pruduz sal e água.
Opção E
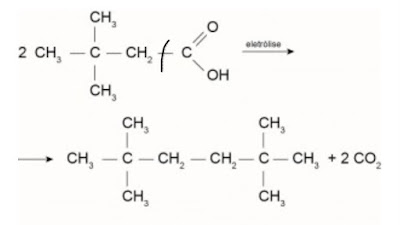
9. (Enem 2015) Hidrocarbonetos podem ser obtidos em laboratório por descarboxilação oxidativa anódica, processo conhecido como eletrossíntese de Kolbe. Essa reação é utilizada na síntese de hidrocarbonetos diversos, a partir de óleos vegetais, os quais podem ser empregados como fontes alternativas de energia, em substituição aos hidrocarbonetos fósseis. O esquema ilustra simplificadamente esse processo.
Com base nesse processo, o hidrocarboneto produzido na eletrólise do ácido 3,3-dimetil-butanoico é o
a) 2,2,7,7-tetrametil-octano.
b) 3,3,4,4-tetrametil-hexano.
c) 2,2,5,5-tetrametil-hexano.
d) 3,3,6,6-tetrametil-octano.
e) 2,2,4,4-tetrametil-hexano.
Resolução:
Opção C
10. (Enem 2013) O glifosato (C3H8NO5P) é um herbicida pertencente ao grupo químico das glicinas, classificado como não seletivo. Esse composto possui os grupos funcionais carboxilato, amino e fosfonato. A degradação do glifosato no solo é muito rápida e realizada por grande variedade de microrganismos, que usam o produto como fonte de energia e fósforo. Os produtos da degradação são o ácido aminometilfosfônico (AMPA) e o N–metilglicina (sarcódios):
A partir do texto e dos produtos de degradação apresentados, a estrutura química que representa o glifosato é:
a)
b)
c)
d)
e)
Resolução:
Tanto a letra b quanto a letra c apresentam os grupos funcionais carboxilato, amino e fosfonato , porém a fórmula molecular do glifosato tem 3 carbonos e por isso não pode ser a letra C, que apresenta quatro carbonos em sua estrutura. A opção correta é a letra b.
Opção B